المواد الفعالة: سورافينيب
نيكسافار ٢٠٠ ملغ: أقراص مغلفة
لماذا يتم استخدام Nexavar؟ لما هذا؟
يستخدم نيكسافار لعلاج سرطان الكبد.
يستخدم Nexavar أيضًا لعلاج سرطان الكلى (سرطان الخلايا الكلوية المتقدم) عندما يكون في مرحلة متقدمة وعندما لا يساعد العلاج القياسي في إيقافه أو يعتبر غير مناسب.
يستخدم نيكسافار لعلاج سرطان الغدة الدرقية (سرطان الغدة الدرقية المتمايز).
Nexavar هو ما يسمى بمثبط متعدد كيناز. وهو يعمل عن طريق إبطاء معدل نمو الخلايا السرطانية ومنع تدفق الدم الذي يسمح للخلايا السرطانية بالنمو.
موانع الاستعمال عندما لا ينبغي استخدام نيكسافار
لا تتناول نيكسافار
- إذا كنت تعاني من حساسية تجاه سورافينيب أو أي من المكونات الأخرى لهذا الدواء (المدرجة في القسم 6).
احتياطات الاستخدام ما الذي تحتاج إلى معرفته قبل تناول نيكسافار
تحدث إلى طبيبك أو الصيدلي قبل تناول نيكسافار.
توخ الحذر مع Nexavar بشكل خاص
- إذا حدثت مشاكل جلدية. يمكن أن يسبب نيكسافار طفح جلدي وردود فعل جلدية ، خاصة على اليدين والقدمين. يمكن للطبيب أن يعالج هذه الأعراض عادةً. خلاف ذلك ، يمكن للطبيب أن يوقف العلاج أو يوقفه تمامًا.
- إذا كنت تعاني من ارتفاع ضغط الدم. يمكن أن يسبب نيكسافار زيادة في ضغط الدم. سيقوم طبيبك بفحص ضغط الدم بانتظام وقد يصف أدوية لعلاج ارتفاع ضغط الدم.
- إذا كنت تعاني من مشاكل نزيف أو إذا كنت تتناول وارفارين أو فينبروكومون. يمكن أن يؤدي العلاج باستخدام نيكسافار إلى زيادة خطر حدوث نزيف. إذا كنت تتناول الوارفارين أو الفينبروكومون ، وهي أدوية تعمل على تسييل الدم لمنع تجلط الدم ، فقد يكون هناك خطر متزايد من حدوث نزيف.
- إذا كنت تعاني من آلام في الصدر أو مشاكل في القلب. قد يقرر طبيبك إيقاف العلاج أو إيقافه تمامًا.
- إذا كنت تعاني من اضطراب في القلب ، مثل "اضطراب في الإشارة الكهربائية يسمى" إطالة كيو تي ".
- إذا كنت على وشك إجراء عملية جراحية أو أجريت لها للتو. يمكن أن يؤثر نيكسافار على التئام الجروح. إذا كنت على وشك إجراء عملية جراحية ، فمن المحتمل أن يتوقف علاجك باستخدام نيكسافار. سيقرر طبيبك بعد ذلك موعد إعادته.
- إذا كنت تعالج بإرينوتيكان أو دوسيتاكسيل ، وهما أيضًا أدوية للسرطان ، يمكن أن يزيد نيكسافار من التأثيرات وخاصة الآثار الجانبية لهذه الأدوية.
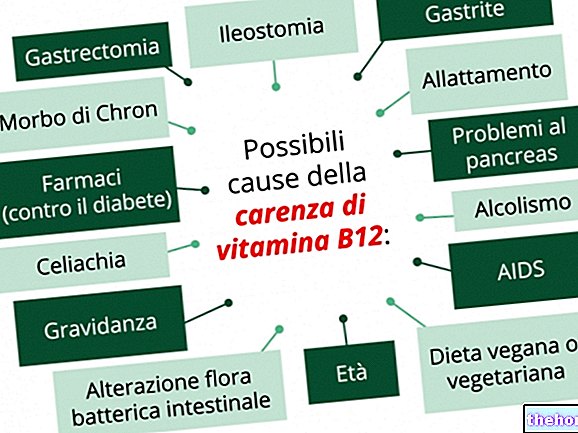
- إذا كنت تتناول نيومايسين أو مضادات حيوية أخرى. قد تنخفض فعالية نيكسافار - إذا كنت تعاني من فشل كبدي حاد.قد تكون لديك آثار جانبية متفاقمة عند تناول هذا الدواء.
- إذا كنت تعاني من قصور في وظائف الكلى. سيراقب طبيبك توازن الماء والكهارل.
- خصوبة. يمكن أن يقلل نيكسافار من الخصوبة لدى كل من الرجال والنساء. إذا كان هذا ينطبق عليك ، تحدث إلى طبيبك.
- قد يحدث ثقب في الجهاز الهضمي أثناء العلاج (انظر القسم 4: الآثار الجانبية المحتملة). في هذه الحالة سيتوقف الطبيب عن العلاج.
- إذا كنت مصابًا بسرطان الغدة الدرقية ، فسيقوم طبيبك بفحص مستويات الكالسيوم وهرمون الغدة الدرقية في دمك.
أخبر طبيبك إذا كان أي منها ينطبق عليك. قد تحتاج إلى علاج لهذه المشاكل ، أو قد يغير طبيبك جرعة نيكسافار ، أو يوقف العلاج تمامًا (انظر أيضًا القسم 4: الآثار الجانبية المحتملة).
الأطفال والمراهقون
لم يتم دراسة نيكسافار بعد عند الأطفال والمراهقين.
التفاعلات: الأدوية أو الأطعمة التي قد تغير من تأثير نيكسافار
يمكن أن تؤثر بعض الأدوية على نيكسافار أو تتأثر به. أخبر طبيبك أو الصيدلي إذا كنت تتناول أو تناولت مؤخرًا أو قد تتناول أيًا من الأدوية المدرجة في هذه القائمة أو أي أدوية أخرى ، بما في ذلك الأدوية التي تم الحصول عليها بدون وصفة طبية:
- ريفامبيسين أو نيومايسين أو أدوية أخرى تُستخدم لعلاج الالتهابات (المضادات الحيوية)
- Hypericum perforatum ، المعروف أيضًا باسم "نبتة سانت جون ، علاج عشبي للاكتئاب
- الفينيتوين ، كاربامازيبين ، الفينوباربيتال ، علاج الصرع وأمراض أخرى.
- ديكساميثازون ، كورتيكوستيرويد يستخدم لأمراض مختلفة
- الوارفارين أو الفينبروكومون ، مضادات التخثر المستخدمة لمنع تجلط الدم
- دوكسوروبيسين ، كابسيتابين ، دوسيتاكسيل ، باكليتاكسيل وإرينوتيكان ، وتستخدم في علاج السرطان.
- يستخدم الديجوكسين في علاج قصور القلب الخفيف أو المتوسط
تحذيرات من المهم معرفة ما يلي:
الحمل والرضاعة
تجنبي الحمل أثناء العلاج ب نيكسافار. إذا كنت في سن الإنجاب ، يجب عليك استخدام وسيلة فعالة لمنع الحمل أثناء العلاج بـ نيكسافار. إذا أصبحت حاملاً أثناء العلاج بـ Nexavar ، أخبر طبيبك على الفور من سيقرر ما إذا كان العلاج يجب أن يستمر أو يتوقف.
يجب عدم إرضاع طفلك أثناء العلاج باستخدام نيكسافار ، حيث يمكن أن يتداخل هذا الدواء مع نمو طفلك وتطوره.
السياقة واستعمال الماكنات
لا يوجد سبب للاعتقاد بأن Nexavar سيؤثر على القدرة على القيادة أو استخدام الآلات.
الجرعة وطريقة ووقت الإدارة كيفية استخدام Nexavar: Posology
الجرعة الموصى بها من نيكسافار للبالغين هي قرصين عيار 200 ملغ مرتين في اليوم.
تتوافق هذه مع جرعة يومية 800 مجم ، أو أربعة أقراص يوميًا. تناول أقراص نيكسافار مع كوب من الماء ، بين الوجبات أو مع الأطعمة قليلة إلى متوسطة الدسم.لا تتناول هذا الدواء مع الأطعمة الدهنية جدًا ، لأن ذلك قد يقلل من فعاليتها. إذا كنت تخطط لتناول أطعمة دهنية جدًا ، فتناول الأقراص قبل ساعة واحدة على الأقل أو ساعتين بعد الغداء. احرص دائمًا على تناول هذا الدواء تمامًا كما أخبرك طبيبك. إذا كنت غير متأكد ، استشر طبيبك أو الصيدلي.
من المهم تناول هذا الدواء في نفس الوقت تقريبًا كل يوم للحفاظ على ثبات التركيز في الدم.
عادة ما يتم تناول هذا الدواء طالما لوحظت الفوائد السريرية ، ولا توجد آثار جانبية لا تطاق.
الجرعة الزائدة ماذا تفعل إذا تناولت الكثير من نيكسافار
إذا تناولت نيكسافار أكثر مما ينبغي
أخبر طبيبك على الفور إذا كنت أنت أو أي شخص آخر قد تناولت أكثر من الجرعة الموصوفة. إن تناول الكثير من Nexavar يجعل الآثار الجانبية أكثر احتمالا أو أكثر خطورة ، وخاصة الإسهال وردود الفعل الجلدية. قد يخبرك طبيبك بالتوقف عن تناول هذا الدواء.
إذا نسيت تناول نيكسافار
إذا نسيت تناول جرعة ، فتناولها حالما تتذكرها. إذا كانت جرعتك التالية بعد فترة وجيزة ، فقم بنسيان الجرعة الفائتة واستمر في التكرار
الآثار الجانبية ما هي الآثار الجانبية لنيكسافار
مثل جميع الأدوية ، يمكن أن يسبب هذا الدواء آثارًا جانبية ، على الرغم من عدم حدوثها لدى الجميع. يمكن لهذا الدواء أيضًا تغيير نتائج بعض اختبارات الدم.
شائع جدا:
قد تظهر لدى أكثر من 1 من كل 10 أشخاص
- إسهال
- الشعور بالضيق (الغثيان).
- الشعور بالضعف أو التعب (التعب).
- ألم (بما في ذلك ألم في الفم والبطن والصداع وآلام العظام وآلام السرطان)
- تساقط الشعر (الثعلبة).
- احمرار أو ألم في راحة اليدين أو باطن القدمين (رد فعل جلد اليد والقدم)
- حكة أو طفح جلدي
- تقيأ
- نزيف (بما في ذلك نزيف في الدماغ وجدار الأمعاء والجهاز التنفسي)
- ارتفاع ضغط الدم أو ارتفاع ضغط الدم (ارتفاع ضغط الدم).
- الالتهابات
- فقدان الشهية (فقدان الشهية).
- إمساك
- آلام المفاصل (arthralgia)
- حمى
- فقدان الوزن
- جفاف الجلد
مشترك:
قد تظهر لدى حتى 1 من كل 10 أشخاص
- مرض يشبه الانفلونزا
- عسر الهضم (عسر الهضم).
- صعوبة في البلع (عسر البلع).
- التهاب أو جفاف الفم ، ألم في اللسان (التهاب الفم والتهاب الغشاء المخاطي).
- انخفاض مستويات الكالسيوم في الدم (نقص كالسيوم الدم).
- انخفاض مستويات البوتاسيوم في الدم (نقص بوتاسيوم الدم).
- ألم عضلي (ألم عضلي)
- اضطرابات الحساسية في أصابع اليدين والقدمين ، بما في ذلك الوخز والتنميل (اعتلال الأعصاب الحسية المحيطية)
- كآبة
- مشاكل الانتصاب (الضعف الجنسي)
- تغيرات في الصوت (بحة الصوت)
- حب الشباب
- الجلد الملتهب والجاف والمتقشر (التهاب الجلد وتقشير الجلد)
- سكتة قلبية
- نوبة قلبية (احتشاء عضلة القلب) أو ألم في الصدر
- طنين الأذن (رنين في الأذنين)
- فشل كلوي
- مستويات عالية من البروتين في البول (بروتينية).
- الضعف العام أو فقدان القوة (الوهن).
- انخفاض عدد خلايا الدم البيضاء (قلة الكريات البيض وقلة العدلات)
- انخفاض عدد خلايا الدم الحمراء (فقر الدم).
- انخفاض عدد الصفائح الدموية في الدم (قلة الصفيحات الدموية).
- التهاب بصيلات الشعر (التهاب الجريبات).
- انخفاض نشاط الغدة الدرقية (قصور الغدة الدرقية)
- انخفاض مستويات الصوديوم في الدم (نقص صوديوم الدم).
- تغيرات في حاسة التذوق (خلل الذوق).
- احمرار الوجه وغالبًا مناطق أخرى من الجلد (احمرار).
- سيلان الأنف (سيلان الأنف)
- حرقة الفؤاد (مرض الجزر المعدي المريئي)
- سرطان الجلد (الورم الشوكي القرني / سرطان الخلايا الحرشفية)
- سماكة الطبقة الخارجية من الجلد (فرط التقرن)
- تقلص عضلي مفاجئ لا إرادي (تشنجات عضلية)
غير مألوف:
قد تظهر لدى حتى 1 من كل 100 شخص
- التهاب المعدة (التهاب المعدة).
- ألم في المعدة (البطن) بسبب التهاب البنكرياس والتهاب المرارة و / أو القنوات الصفراوية
- اصفرار الجلد أو العينين (اليرقان) الناجم عن مستويات عالية من الصبغات الصفراوية (فرط بيليروبين الدم)
- ردود الفعل التحسسية (بما في ذلك ردود الفعل الجلدية وخلايا النحل)
- تجفيف
- تضخم الثدي (التثدي)
- صعوبة في التنفس (مرض الرئة).
- الأكزيما
- نشاط الغدة الدرقية المفرط (فرط نشاط الغدة الدرقية)
- طفح جلدي متعدد (حمامي عديدة الأشكال)
- ضغط دم مرتفع
- انثقاب الجهاز الهضمي
- الوذمة العكوسة في الجزء الخلفي من الدماغ والتي قد تترافق مع الصداع وتغير الوعي والنوبات والأعراض البصرية بما في ذلك فقدان الرؤية (اعتلال بيضاء الدماغ الخلفي القابل للانعكاس)
- رد فعل تحسسي مفاجئ وشديد (تفاعل تأقي)
نادر:
قد تظهر لدى حتى 1 من كل 1000 شخص
- رد فعل تحسسي مع انتفاخ الجلد (مثل الوجه واللسان) والذي قد يسبب صعوبة في التنفس والبلع (وذمة وعائية).
- عدم انتظام ضربات القلب (إطالة كيو تي)
- التهاب الكبد الذي يمكن أن يؤدي إلى الغثيان والقيء وآلام البطن واليرقان (التهاب الكبد الناجم عن الأدوية)
- طفح جلدي شبيه بحروق الشمس على الجلد الذي سبق تعرضه للعلاج الإشعاعي وقد يكون شديدًا (التهاب الجلد الشعاعي)
- ردود فعل شديدة للجلد و / أو الأغشية المخاطية التي قد تشمل بثور مؤلمة وحمى ، مع انفصال مناطق كبيرة من الجلد (متلازمة ستيفنز جونسون وانحلال البشرة السمي)
- انهيار عضلي غير طبيعي يمكن أن يؤدي إلى مشاكل في الكلى (انحلال الربيدات)
- تلف الكلى الذي يسبب فقدان كميات كبيرة من البروتين في البول (المتلازمة الكلوية).
- التهاب الأوعية الدموية في الجلد الذي قد يظهر على شكل طفح جلدي (التهاب الأوعية الدموية الكريات البيض).
غير معروف:
لا يمكن تقدير التردد من البيانات المتاحة
- ضعف وظائف المخ التي قد تترافق على سبيل المثال بالنعاس أو التغيرات السلوكية أو الارتباك (اعتلال الدماغ)
التبليغ عن الأعراض الجانبية
إذا ظهرت لديك أي أعراض جانبية ، تحدث إلى طبيبك أو الصيدلي ، وهذا يشمل أي آثار جانبية محتملة غير مذكورة في هذه النشرة. يمكنك أيضًا الإبلاغ عن الآثار الجانبية مباشرةً عبر نظام الإبلاغ الوطني المدرج في الملحق الخامس. من خلال الإبلاغ عن الآثار الجانبية ، يمكنك المساعدة في توفير مزيد من المعلومات حول سلامة هذا الدواء.
انتهاء الصلاحية والاحتفاظ
احفظ هذا الدواء بعيدًا عن رؤية ومتناول أيدي الأطفال.
لا تستخدم هذا الدواء بعد تاريخ انتهاء الصلاحية المدون على الكرتون بعد EXP وعلى كل نفطة بعد EXP. يشير تاريخ انتهاء الصلاحية إلى اليوم الأخير من نفس الشهر.
لا تقم بتخزين هذا الدواء فوق 25 درجة مئوية.
لا تقم بإلقاء أي أدوية في مياه الصرف الصحي أو النفايات المنزلية ، اسأل الصيدلي عن كيفية التخلص من الأدوية التي لم تعد تستخدمها ، فهذا سيساعد في حماية البيئة.
ماذا يحتوي نيكسافار
- العنصر النشط هو سورافينيب. يحتوي كل قرص مغلف على 200 ملغ سورافينيب (على شكل توسيلات).
- المكونات الأخرى هي: قلب القرص: كروسكارميلوز الصوديوم ، السليلوز الجريزوفولفين ، هيدروكسي بروبيل ، كبريتات لوريل الصوديوم وستيرات المغنيسيوم. طلاء القرص: هيدروكسي بروبيل ، ماكروغول ، ثاني أكسيد التيتانيوم (E 171) وأكسيد الحديد الأحمر (E 172)
كيف يبدو نيكسافار وما هي محتويات العبوة
أقراص نيكسافار 200 ملغ مغلفة بالفيلم حمراء ومستديرة ، مع صليب باير على جانب واحد و "200" على الجانب الآخر ، وهي مقدمة في علب كرتونية بها 112 قرصاً ، تحتوي على أربع بثور تقويمية شفافة كل منها 28 قرصاً.
نشرة حزمة المصدر: AIFA (وكالة الأدوية الإيطالية). تم نشر المحتوى في يناير 2016. المعلومات الموجودة قد لا تكون محدثة.
للوصول إلى أحدث إصدار ، يُنصح بالوصول إلى موقع AIFA (وكالة الأدوية الإيطالية). إخلاء المسؤولية والمعلومات المفيدة.
01.0 اسم المنتج الطبي
نيكسافار 200 مجم
02.0 التركيب النوعي والكمي
يحتوي كل قرص مغلف على 200 ملغ سورافينيب (على شكل توسيلات).
للحصول على قائمة كاملة من السواغات ، انظر القسم 6.1.
03.0 الشكل الصيدلاني
قرص مغلف بالفيلم (قرص).
أقراص حمراء ، مستديرة ، محدبة من الجانبين ، مغلفة بالفيلم عليها علامة باير على جانب واحد و "200" على الجانب الآخر.
04.0 المعلومات السريرية
04.1 المؤشرات العلاجية
سرطان الكبد
يوصف نيكسافار لعلاج سرطان الخلايا الكبدية (انظر القسم 5.1).
سرطان الخلايا الكلوية
يشار إلى Nexavar لعلاج المرضى الذين يعانون من سرطان الخلايا الكلوية المتقدم الذين فشلوا في علاج مضاد للفيروسات ألفا أو إنترلوكين -2 ، أو الذين يعتبرون غير مؤهلين لمثل هذا العلاج.
سرطان الغدة الدرقية المتمايز
يستخدم نيكسافار لعلاج المرضى المصابين بسرطان الغدة الدرقية المتقدم محليًا أو النقيلي ، التقدمي ، سرطان الغدة الدرقية المتمايز باليود المشع (الخلايا الحليمية / الجريبية / خلية هورتل).
04.2 الجرعة وطريقة الإدارة
يجب أن يكون العلاج باستخدام نيكسافار تحت إشراف طبيب خبير في استخدام العلاجات المضادة للسرطان.
الجرعة
الجرعة الموصى بها من نيكسافار للبالغين هي 400 مجم سورافينيب (قرصان 200 مجم) مرتين يوميًا (ما يعادل إجمالي جرعة يومية 800 مجم).
يجب أن يستمر العلاج طالما لوحظت الفائدة السريرية ، أو حتى تظهر سمية غير مقبولة.
تعديل الجرعة
قد تتطلب إدارة التفاعلات الدوائية الضارة المشتبه بها مقاطعة مؤقتة أو تقليل جرعة علاج سورافينيب.
عندما يكون خفض الجرعة مطلوبًا أثناء علاج سرطان الخلايا الكبدية (سرطانة الخلايا الكبدية، HCC) وسرطان الخلايا الكلوية (سرطان الخلايا الكلوية، RCC) ، يجب تقليل جرعة نيكسافار إلى قرصين 200 ملغ من سورافينيب مرة واحدة يوميًا (انظر القسم 4.4).
عندما يكون خفض الجرعة مطلوبًا أثناء علاج سرطان الغدة الدرقية المتمايز (سرطان الغدة الدرقية المتمايز، DTC) ، يجب تقليل جرعة نيكسافار إلى 600 مجم سورافينيب في اليوم بجرعات مقسمة (قرصان 200 مجم و قرص واحد 200 مجم بفاصل اثنتي عشرة ساعة).
إذا كان هناك حاجة إلى مزيد من التخفيض في الجرعة ، يمكن تقليل Nexavar إلى 400 مجم سورافينيب يوميًا بجرعات مقسمة (قرصان 200 مجم بفاصل اثنتي عشرة ساعة) ، وإذا لزم الأمر ، يتم تقليله إلى قرص واحد 200 مجم مرة واحدة يوميًا بعد التحسين غير الدموي ردود الفعل السلبية ، يمكن زيادة جرعة نيكسافار.
سكان الأطفال
سلامة وفعالية نيكسافار لدى الأطفال الأكبر سنًا والمراهقين
السكان المسنين
بالنسبة لكبار السن (المرضى الذين تزيد أعمارهم عن 65 عامًا) لا يلزم تعديل الجرعة.
القصور الكلوي
لا يلزم تعديل الجرعة للمرضى المصابين بقصور كلوي خفيف أو متوسط أو شديد. لا توجد بيانات متاحة عن مرضى غسيل الكلى (انظر القسم 5.2).
ينصح بمراقبة توازن الماء والكهارل في المرضى المعرضين لخطر الإصابة بالقصور الكلوي.
اختلال كبدي
لا يلزم تعديل الجرعة للمرضى الذين يعانون من اختلال كبدي طفل Pugh A أو B (خفيف إلى متوسط). لا توجد بيانات متاحة عن المرضى الذين يعانون من اختلال كبدي شديد لدى Child Pugh C (انظر القسمين 4.4 و 5.2).
طريقة الإعطاء
للاستخدام عن طريق الفم
يجب تناول سورافينيب بين الوجبات أو مع وجبة قليلة أو معتدلة الدهون. إذا كان المريض ينوي تناول وجبة غنية بالدهون ، يجب تناول أقراص سورافينيب قبل ساعة واحدة على الأقل من الوجبة أو بعد ساعتين من الوجبة ، ويجب بلع الأقراص مع كوب من الماء.
04.3 موانع الاستعمال
فرط الحساسية للمادة الفعالة أو لأي من السواغات المدرجة في القسم 6.1.
04.4 تحذيرات خاصة واحتياطات مناسبة للاستخدام
سمية جلدية
رد فعل جلد اليد والقدم (التخدير الدموي الراحي - الأخمصي) هـ متسرع تمثل ردود الفعل السلبية الأكثر شيوعًا تجاه سورافينيب. متسرع وعادة ما يكون رد فعل الجلد اليدوي والقدم من الدرجة 1 و 2 ، وفقًا لـ i معايير السمية الشائعة (CTC) ، وتظهر بشكل عام خلال الأسابيع الستة الأولى من علاج سورافينيب. قد تشمل إدارة السمية الجلدية علاجات موضعية لتخفيف الأعراض ، و / أو التوقف المؤقت للعلاج و / أو تغيير جرعة سورافينيب ، أو في الحالات الشديدة أو المستمرة ، التوقف النهائي عن تناوله (انظر القسم 4.8).
ارتفاع ضغط الدم
لوحظ ارتفاع معدل الإصابة بارتفاع ضغط الدم الشرياني في المرضى الذين عولجوا بسورافينيب ، وكان ارتفاع ضغط الدم لدى هؤلاء المرضى عادة خفيفًا إلى متوسط ، ويحدث في المراحل المبكرة من العلاج ، ويستجيب للعلاج القياسي الخافض للضغط. يجب مراقبة ضغط الدم بانتظام ومعالجته حسب الضرورة وفقًا للممارسات الطبية الحالية. في حالة ارتفاع ضغط الدم الشديد أو المستمر ، أو أزمة ارتفاع ضغط الدم ، على الرغم من بدء العلاج الخافض للضغط ، فمن المستحسن النظر في التوقف عن إعطاء سورافينيب بشكل دائم (انظر القسم 4.8).
نزف
قد يزداد خطر النزيف بعد تناول سورافينيب. إذا كانت نوبة النزف تتطلب تدخلًا طبيًا ، فمن المستحسن النظر في التوقف الدائم عن تناول عقار سورافينيب (انظر القسم 4.8).
نقص تروية القلب و / أو النوبة القلبية
في دراسة مزدوجة التعمية ، عشوائية ، مضبوطة بالغفل (الدراسة 1 ، انظر القسم 5.1) ، كان معدل حدوث احتشاء قلبي أو نقص تروية بداية العلاج أعلى في مجموعة سورافينيب (4.9٪) منه في مجموعة العلاج. 0.4٪) في الدراسة 3 (انظر القسم 5.1) كانت نسبة حدوث النوبة القلبية أو نقص تروية القلب الناتجة أثناء العلاج 2.7٪ في المرضى الذين عولجوا ب سورافينيب و 1.3٪ في المرضى الذين عولجوا بدواء وهمي. تم استبعاد المرضى الذين يعانون من مرض الشريان التاجي غير المستقر أو الذين يعانون من احتشاء عضلة القلب مؤخرًا من هذه الدراسات. يجب مراعاة الحاجة إلى التوقف المؤقت أو الدائم عن علاج سورافينيب في المرضى الذين يعانون من نقص تروية القلب و / أو احتشاء (انظر القسم 4.8).
إطالة فترة QT
لقد ثبت أن سورافينيب يطيل فترة QT / QTc (انظر القسم 5.1) ، مما قد يؤدي إلى زيادة خطر عدم انتظام ضربات القلب البطيني. المتلازمة ، أولئك الذين عولجوا بجرعة تراكمية عالية من الأنثراسيكلين ، والمرضى الذين يتناولون بعض الأدوية المضادة لاضطراب النظم أو الأدوية الأخرى التي يمكن أن تؤدي إلى إطالة كيو تي ، وأولئك الذين يعانون من اضطرابات الكهارل ، على سبيل المثال نقص بوتاسيوم الدم ونقص كالسيوم الدم أو نقص مغنسيوم الدم عند استخدام سورافينيب في هؤلاء المرضى ، يجب إجراء قياسات الكهارل (المغنيسيوم والبوتاسيوم والكالسيوم) خلال فترة العلاج.
انثقاب الجهاز الهضمي
انثقاب الجهاز الهضمي هو حدث غير شائع وقد تم الإبلاغ عنه في أقل من 1 ٪ من المرضى الذين يتناولون سورافينيب. في بعض الحالات ، لم يكن هناك ارتباط مع ورم واضح داخل البطن. في حالة حدوث ثقب في الجهاز الهضمي ، يجب التوقف عن إعطاء سورافينيب (انظر القسم 4.8).
اختلال كبدي
لا توجد بيانات متاحة في المرضى الذين يعانون من اختلال كبدي شديد (Child Pugh C). في مثل هؤلاء المرضى ، يمكن زيادة التعرض حيث يتم التخلص من سورافينيب بشكل أساسي عن طريق الكبد (انظر القسمين 4.2 و 5.2).
الإدارة المصاحبة للوارفارين
نوبات نزيف غير متكررة أو زيادة في INR (تطبيع دولي
نسبة) في بعض المرضى الذين تناولوا الوارفارين خلال العلاج بالسورافينيب. يجب مراقبة المرضى الذين يتناولون الوارفارين أو الفينبروكومون بانتظام لمعرفة التغيرات في زمن البروثرومبين أو INR أو نوبات النزف ذات الصلة سريريًا (انظر القسمين 4.5 و 4.8).
مضاعفات التئام الجروح
لم يتم إجراء أي دراسات رسمية حول تأثير سورافينيب على التئام الجروح.يوصى بالتعليق المؤقت لعلاج سورافينيب لأسباب وقائية في المرضى الذين يخضعون لعملية جراحية كبرى.الخبرة السريرية فيما يتعلق بموعد بدء العلاج بعد الجراحة الكبرى محدودة. لذلك ، يجب أن يستند قرار استئناف علاج سورافينيب بعد الجراحة الكبرى إلى التقييم السريري لالتئام الجروح الكافي.
السكان المسنين
تم الإبلاغ عن حالات الفشل الكلوي. لذلك ، ينبغي النظر في مراقبة وظائف الكلى.
التفاعل بين الأدوية
ينصح بالحذر عند إعطاء سورافينيب بالمواد التي يتم استقلابها و / أو التخلص منها في الغالب عبر مسارات UGT1A1 (مثل irinotecan) أو UGT1A9 (انظر القسم 4.5).
ينصح بالحذر في حالة ما يصاحب ذلك من تعاطي سورافينيب ودوسيتاكسيل (انظر القسم 4.5).
قد يؤدي الدمج مع النيومايسين أو المضادات الحيوية الأخرى القادرة على إحداث اضطرابات بيئية خطيرة في البكتيريا المعوية الدقيقة إلى انخفاض التوافر الحيوي لسورافينيب (انظر القسم 4.5) ، ويجب تقييم خطر انخفاض تركيز سورافينيب في البلازما قبل البدء. دورة العلاج بالمضادات الحيوية.
لوحظ ارتفاع معدل الوفيات في المرضى الذين يعانون من سرطان الرئة الخلايا الحرشفية الذين عولجوا باستخدام سورافينيب بالاشتراك مع العلاج الكيميائي البلاتيني.
في تجربتين سريريتين عشوائيتين ، درستا مرضى سرطان الرئة ذو الخلايا غير الصغيرة (سرطان الرئة ذو الخلايا غير الصغيرة، NSCLC) ، كانت نسبة الخطر (HR) للبقاء الكلي في مجموعة فرعية من المرضى المصابين بسرطان الرئة الحرشفية 1.81 (95٪ CI 1.19 ، 2.74) في المرضى الذين عولجوا باستخدام سورافينيب بالإضافة إلى علاج باكليتاكسيل / كاربوبلاتين و 1.22 (95٪) CI 0.82؛ 1.80) في المرضى الذين عولجوا بسورافينيب بالإضافة إلى علاج جيمسيتابين / سيسبلاتين. لم يلاحظ أي سبب سائد للوفاة ، ولكن لوحظ حدوث زيادة في حالات فشل الجهاز التنفسي والنزيف والعدوى في المرضى الذين عولجوا باستخدام سورافينيب بالإضافة إلى العلاج القائم على البلاتين.
تحذيرات خاصة بعلم الأمراض
سرطان الغدة الدرقية المتمايز (DTC)
قبل بدء العلاج ، يُنصح الأطباء بإجراء تقييم دقيق لتوقعات المريض الفردية بناءً على حجم الآفة الأقصى (انظر القسم 5.1) ، والأعراض المرتبطة بالمرض (انظر القسم 5.1) ومعدل التقدم.
قد تتطلب إدارة التفاعلات الدوائية الضارة المشتبه بها "توقفًا مؤقتًا أو تقليل جرعة علاج سورافينيب. في الدراسة 5 (انظر القسم 5.1) ، توقف 37 ٪ من الأشخاص عن العلاج مؤقتًا و 35 ٪ خفضوا الجرعة في وقت مبكر من الدورة الأولى من علاج سورافينيب.
كان تقليل الجرعة فعالاً جزئياً فقط في التخفيف من التفاعلات الضائرة ، لذلك يوصى بتكرار تقييمات الفوائد والمخاطر ، مع الأخذ في الاعتبار النشاط المضاد للورم والتحمل.
نزيف في DTC
بسبب المخاطر المحتملة للنزيف ، يجب علاج تسلل القصبة الهوائية والشعب الهوائية والمريء بالعلاج الموضعي قبل إعطاء سورافينيب للمرضى الذين يعانون من DTC.
نقص كالسيوم الدم في DTC
عند استخدام سورافينيب في المرضى الذين يعانون من DTC ، يوصى بمراقبة دقيقة لمستويات الكالسيوم في الدم. في التجارب السريرية ، كان نقص كالسيوم الدم أكثر تواترًا وشدة في المرضى الذين يعانون من DTC ، خاصة في المرضى الذين لديهم تاريخ من قصور الدريقات ، مقارنة بالمرضى المصابين بسرطان الخلايا الكلوية أو سرطان الكبد. حدث نقص كالسيوم الدم من الدرجة 3 و 4. يتجلى في 6.8٪ و 3.4٪ من المرضى الذين عولجوا من سورافينيب مع DTC (انظر القسم 4.8). يجب تصحيح نقص كالسيوم الدم الشديد لمنع حدوث مضاعفات مثل إطالة فترة QT أو torsades de pointes (انظر قسم إطالة فترة QT).
قمع TSH في DTC
في الدراسة 5 (انظر القسم 5.1) ، لوحظت زيادات في مستويات TSH أكبر من 0.5 ملي / لتر في المرضى الذين عولجوا باستخدام سورافينيب. يوصى بالمراقبة الدقيقة لمستويات TSH عند استخدام سورافينيب في المرضى الذين يعانون من DTC.
سرطان الخلايا الكلوية
المرضى المعرضون لمخاطر عالية ، على النحو المحدد من قبل مجموعة MSKCC التنبؤية (مركز ميموريال سلون كيترينج للسرطان) ، لم يتم تضمينها في الدراسة السريرية للمرحلة الثالثة في سرطان الخلايا الكلوية (انظر الدراسة 1 في القسم 5.1) ولم يتم تحديد نسبة الفائدة إلى المخاطر في هؤلاء المرضى.
04.5 التفاعلات مع المنتجات الطبية الأخرى وأشكال التفاعل الأخرى
محرضات الإنزيمات الأيضية
أدى إعطاء ريفامبيسين لمدة 5 أيام قبل إعطاء جرعة واحدة من سورافينيب إلى انخفاض متوسط من مادة سورافينيب AUC بنسبة 37٪. عشبة القديس يوحنا المعروف أيضا باسم "نبتة سانت جون" ، الفينيتوين ، كاربامازيبين ، الفينوباربيتال وديكساميثازون) يمكن أن يزيد من استقلاب سورافينيب وبالتالي يقلل من تركيزه.
مثبطات CYP3A4
الكيتوكونازول ، وهو مثبط قوي لـ CYP3A4 ، يُعطى مرة واحدة يوميًا لمدة 7 أيام لمتطوعين من الذكور الأصحاء لم يغير متوسط المساحة تحت المنحنى لجرعة واحدة 50 مجم من سورافينيب.وتشير هذه البيانات إلى أن التفاعلات السريرية الحركية للسورافينيب مع مثبطات CYP3A4 غير مرجحة.
ركائز CYP2B6 و CYP2C8 و CYP2C9
في المختبر يثبط سورافينيب CYP2B6 و CYP2C8 و CYP2C9 بقوة متساوية تقريبًا. ومع ذلك ، في دراسات الحرائك الدوائية السريرية ، لم ينتج عن التناول المشترك لسورافينيب 400 مجم مرتين يوميًا مع سيكلوفوسفاميد ، أو ركيزة CYP2B6 ، أو باكليتاكسيل ، وهو ركيزة CYP2C8 ، تثبيط مهم سريريًا. تشير هذه البيانات إلى أن سورافينيب ، بالجرعة الموصى بها 400 ملغ مرتين يوميا ، قد لا يكون مثبط في الجسم الحي CYP2B6 أو CYP2C8.
علاوة على ذلك ، فإن العلاج المتزامن مع سورافينيب ووارفارين ، وهو ركيزة من CYP2C9 ، لم يؤد إلى تغييرات في متوسط PT-INR مقارنة بالدواء الوهمي. لذلك ، أيضا من خطر "التثبيط في الجسم الحي يمكن اعتبار CYP2C9 ذي الصلة سريريًا بواسطة سورافينيب منخفضًا. ومع ذلك ، يجب أن يخضع المرضى الذين يتناولون الوارفارين أو الفينبروكومون لمراقبة INR بانتظام (انظر القسم 4.4).
ركائز CYP3A4 و CYP2D6 و CYP2C19
لم يغير التناول المتزامن لسورافينيب وميدازولام وديكستروميتورفان أو أوميبرازول ، وهي ركائز السيتوكروم CYP3A4 و CYP2D6 و CYP2C19 على التوالي من التعرض لهذه العوامل ، وهذا يشير إلى أن سورافينيب ليس مثبطًا أو محفزًا لهذه الإنزيمات. ، التفاعلات الدوائية السريرية من سورافينيب مع ركائز هذه الإنزيمات غير مرجحة.
ركائز UGT1A1 و UGT1A9
في المختبر، سورافينيب يثبط الجلوكورونيد بواسطة UGT1A1 و UGT1A9. الصلة السريرية لهذه النتيجة غير معروفة (انظر أدناه والقسم 4.4).
تعليم في المختبر على تحريض إنزيمات نظام CYP
لم يتم تغيير أنشطة CYP1A2 و CYP3A4 بعد تعرض مزارع خلايا الكبد البشرية إلى سورافينيب ، مما يشير إلى أنه من غير المحتمل أن يكون سورافينيب محفزًا لـ CYP1A2 و CYP3A4.
ركائز لـ P-gp
في المختبر، لقد ثبت أن سورافينيب يثبط نقل البروتين p-glycoprotein (P-gp). في حالة العلاج المتزامن مع سورافينيب ، لا يمكن استبعاد زيادة تركيز البلازما لركائز P-gp ، مثل الديجوكسين.
الارتباط بعوامل أخرى مضادة للأورام
في الدراسات السريرية ، تم إعطاء سورافينيب مع عدد من العوامل الأخرى المضادة للأورام في مواضعها الشائعة الاستخدام ، بما في ذلك جيمسيتابين ، سيسبلاتين ، أوكساليبلاتين ، باكليتاكسيل ، كاربوبلاتين ، كابسيتابين ، دوكسوروبيسين ، إرينوتيكان ، دوسيتاكسيل وسيكلوفوسفاميد. لم يكن لـ Sorafenib أي تأثير ذي صلة سريريًا على الحرائك الدوائية لـ gemcitabine أو cisplatin أو carboplatin أو oxaliplatin أو cyclophosphamide.
باكليتاكسيل / كاربوبلاتين
• إعطاء باكليتاكسيل (225 مجم / م 2) وكاربوبلاتين (AUC = 6) مع سورافينيب (≤ 400 مجم مرتين يوميًا) ، مع انقطاع لمدة 3 أيام لإعطاء سورافينيب (اليومان السابقان ويوم إعطاء باكليتاكسيل / كاربوبلاتين) ) ، ليس له تأثير معنوي على الحرائك الدوائية للباكليتاكسيل.
• أدى تناول باكليتاكسيل (225 مجم / م 2 مرة كل 3 أسابيع) وكاربوبلاتين (AUC = 6) مع سورافينيب (400 مجم مرتين يوميًا دون انقطاع جرعات سورافينيب) إلى زيادة بنسبة 47٪ في التعرض للسورافينيب بنسبة 29٪ زيادة في التعرض للباكليتاكسيل وزيادة بنسبة 50٪ في التعرض 6-أوه باكليتاكسيل. لم تتأثر الحرائك الدوائية للكاربوبلاتين.
تشير هذه البيانات إلى أنه لا يلزم تعديل الجرعة عند تناول باكليتاكسيل وكاربوبلاتين بشكل مشترك مع سورافينيب مع انقطاع لمدة 3 أيام لإعطاء سورافينيب (اليومان السابقان ويوم إعطاء باكليتاكسيل / كاربوبلاتين). زيادة التعرض لسورافينيب وباكليتاكسيل بعد فترة وجيزة من تناول سورافينيب دون انقطاع الجرعات.
كابيسيتابين
لم يؤد تناول الكابسيتابين المتزامن (750 - 1050 مجم / م 2 مرتين يوميًا ، الأيام من 1 إلى 14 كل 21 يومًا) والسورافينيب (200 أو 400 مجم مرتين يوميًا دون انقطاع الجرعات) إلى تغيرات كبيرة في التعرض لسورافينيب ، ولكن تأثير 15 - زيادة بنسبة 50٪ في التعرض للـ Capecitabine وزيادة بنسبة 0-52٪ في التعرض لـ 5-FU. الصلة السريرية لهذه الزيادات الصغيرة المتواضعة في التعرض لـ 5-FU غير معروفة. capecitabine و 5-FU عند تناولهما مع سورافينيب.
دوكسوروبيسين / إرينوتيكان
نتج عن العلاج المتزامن مع سورافينيب زيادة بنسبة 21٪ في المساحة تحت المنحنى للدوكسوروبيسين. عند تناوله مع إيرينوتيكان ، الذي يتم استقلاب مستقلبه SN-38 بعد ذلك عبر مسار UGT1A1 ، كانت هناك زيادة بنسبة 67-120٪ في "المساحة تحت المنحنى لـ SN-38 و 26 - 42٪ في الجامعة الأمريكية بالقاهرة من irinotecan ". الصلة السريرية لهذه البيانات غير معروفة (انظر القسم 4.4).
دوسيتاكسيل
Docetaxel (جرعة 75 أو 100 مجم / م 2 كل 21 يومًا) تدار بشكل متزامن مع سورافينيب (200 مجم أو 400 مجم مرتين يوميًا في الأيام من 2 إلى 19 من دورة علاج مدتها 21 يومًا ، مع "3 أيام تتوافق مع إعطاء الدوسيتاكسيل" ) أدى إلى زيادة في docetaxel AUC و Cmax بنسبة 36 - 80٪ و 16 - 32٪ على التوالي ، ويوصى بالحذر عند تناوله بشكل مشترك مع سورافينيب ودوسيتاكسيل (انظر القسم 4.4).
الارتباط مع وكلاء آخرين
نيومايسين
إن الدمج مع نيومايسين ، وهو عامل مضاد للميكروبات غير جهازي يستخدم للقضاء على الفلورا المعوية ، يتداخل مع إعادة الدوران المعوي الكبدي من سورافينيب (انظر القسم 5.2 ، التحول الحيوي والتمثيل الغذائي) ، مما يؤدي إلى انخفاض التعرض لسورافينيب. في متطوعين أصحاء يعالجون بالنيومايسين لمدة 5 يومًا ، انخفض متوسط التعرض للسورافينيب بنسبة 54٪. لم تتم دراسة تأثيرات المضادات الحيوية الأخرى ولكن من المرجح أن تعتمد على قدرتها على التدخل في الكائنات الحية الدقيقة مع نشاط الجلوكورونيداز.
04.6 الحمل والرضاعة
حمل
لا توجد بيانات عن استخدام سورافينيب في النساء الحوامل.أظهرت الدراسات التي أجريت على الحيوانات سمية إنجابية ، بما في ذلك التشوهات (انظر القسم 5.3). لقد ثبت أن سورافينيب ومستقلباته تعبر المشيمة في الفئران ، ومن المتوقع أن يسبب سورافينيب آثارًا ضارة على الجنين. لا ينبغي استخدام سورافينيب أثناء الحمل ما لم يكن ذلك ضروريًا بشكل واضح وفقط بعد "دراسة متأنية لاحتياجات الأم والمخاطر على الجنين".
يجب على النساء في سن الإنجاب استخدام وسائل منع الحمل الفعالة أثناء العلاج.
وقت الأكل
من غير المعروف ما إذا كان سورافينيب يُفرز في حليب الأم. في الحيوانات ، يتم إفراز سورافينيب و / أو مستقلباته في الحليب ، بما أن سورافينيب قد يضعف نمو وتطور حديثي الولادة (انظر القسم 5.3) ، يجب على النساء التوقف عن الرضاعة الطبيعية أثناء العلاج باستخدام سورافينيب.
خصوبة
تظهر الدراسات التي أجريت على الحيوانات أن سورافينيب قد يضعف خصوبة الذكور والإناث (انظر القسم 5.3).
04.7 التأثيرات على القدرة على السياقة واستعمال الآلات
لم يتم إجراء أي دراسات حول القدرة على القيادة أو استخدام الآلات. لا يوجد سبب للاعتقاد بأن سورافينيب يؤثر على القدرة على القيادة أو استخدام الآلات.
04.8 الآثار غير المرغوب فيها
كانت أهم التفاعلات الضائرة الخطيرة هي نقص تروية عضلة القلب واحتشاءها وانثقاب الجهاز الهضمي والتهاب الكبد الدوائي والنزيف وارتفاع ضغط الدم أو أزمة ارتفاع ضغط الدم.
كانت التفاعلات الضائرة الأكثر شيوعًا هي الإسهال ، والوهن ، والثعلبة ، والعدوى ، وتفاعل الجلد في اليد والقدم (يتوافق في MedDRA مع "متلازمة الإحساس الحُمرى الراحي الأخمصي") و متسرع.
تم سرد التفاعلات العكسية التي تم الإبلاغ عنها في التجارب السريرية المختلفة أو استخدام ما بعد التسويق في الجدول 1 ، مرتبة حسب MedDRA والتردد. يتم تعريف الترددات على النحو التالي: شائعة جدًا (≥1 / 10) ، شائعة (≥1 / 100 ،
داخل كل فئة تردد ، يتم عرض التأثيرات غير المرغوب فيها بترتيب تنازلي من حيث الشدة.
الجدول 1: ردود الفعل السلبية العامة المبلغ عنها في المرضى في تجارب سريرية مختلفة أو في استخدام ما بعد التسويق.
* يمكن أن تكون التفاعلات العكسية مهددة للحياة أو مميتة. هذه الأحداث إما غير شائعة أو أقل تكرارًا من غير المألوفة.
** رد فعل جلد اليد والقدم يتوافق مع متلازمة الإحساس الدموي الراحي الأخمصي في MedDRA
تعلم المزيد عن بعض ردود الفعل السلبية
فشل القلب الاحتقاني
في دراسة سريرية برعاية الشركة ، تم الإبلاغ عن فشل القلب الاحتقاني كحدث عكسي في 1.9 ٪ من المرضى الذين عولجوا باستخدام سورافينيب (N = 2276). في الدراسة 11213 (RCC) تم الإبلاغ عن الأحداث الضائرة المتوافقة مع قصور القلب الاحتقاني في 1.7 ٪ من المرضى المعالجين بالسورافينيب و 0.7 ٪ من المرضى المعالجين بالغفل. في الدراسة 100554 (HCC) تم الإبلاغ عن مثل هذه الأحداث في 0.99٪ من المرضى المعالجين بالسورافينيب و 1.1٪ من المرضى المعالجين بالغفل.
معلومات إضافية لفئات خاصة
في الدراسات السريرية ، حدثت بعض التفاعلات الدوائية الضائرة ، مثل تفاعل الجلد في اليد والقدم ، والإسهال ، والثعلبة ، وفقدان الوزن ، وارتفاع ضغط الدم ، ونقص كالسيوم الدم ، وورم القرنية الشائكة / سرطان الخلايا الحرشفية ، مع تواتر أعلى بكثير في المرضى الذين يعانون من سرطان الغدة الدرقية المتمايز مقارنة بالمرضى المدرجة في دراسات سرطان الخلايا الكلوية أو الكبدية.
التغييرات في الفحوصات المخبرية لدى مرضى سرطان الكبد (دراسة 3) وسرطان الخلايا الكلوية (دراسة 1)
تم الإبلاغ عن زيادة في الليباز والأميليز بشكل شائع ، زيادة الدرجة 3 أو 4 في الليباز معايير السمية الشائعةحدثت الأحداث الضائرة (CTCAE) في 11٪ و 9٪ من المرضى في مجموعة سورافينيب في الدراسة 1 (RCC) والدراسة 3 (HCC) ، على التوالي ، مقابل 7٪ و 9٪ من المرضى في مجموعة سورافينيب. حدث ارتفاع الأميليز من الدرجة 3 أو 4 في CTCAE في 1٪ و 2٪ من المرضى في مجموعة سورافينيب في الدراسة 1 والدراسة 3 ، على التوالي ، مقابل 3٪ من المرضى في كلتا المجموعتين الوهمي. تم الإبلاغ عن التهاب البنكرياس السريري في 2 من 451 مريضًا تم علاجه باستخدام سورافينيب (CTCAE Grade 4) في الدراسة 1 ، في 1 من 297 مريضًا تم علاجهم باستخدام سورافينيب (CTCAE Grade 2) في الدراسة 3 وفي 1 من 451 مريضًا (CTCAE Grade 2) عولجوا بدواء وهمي في الدراسة 1.
يعتبر نقص الفوسفات في الدم نتيجة مخبرية شائعة جدًا ، وقد لوحظ في 45٪ و 35٪ من المرضى المعالجين بالسورافينيب في الدراسة 1 والدراسة 3 ، على التوالي ، مقابل 12٪ و 11٪ من المرضى المعالجين بالغفل ، على التوالي. حدث نقص فوسفات الدم من الدرجة 3 CTCAE (1 - 2 مجم / ديسيلتر) في الدراسة 1 في 13٪ من المرضى المعالجين بالسورافينيب وفي 3٪ من المرضى المعالجين بالغفل ، بينما حدث في الدراسة 3 في 11٪ من المرضى الذين عولجوا باستخدام سورافينيب وفي 2٪ من المرضى الذين عولجوا بالدواء الوهمي لم يتم الإبلاغ عن حالات نقص فوسفات الدم من الدرجة 4 CTCAE (مسببات نقص فوسفات الدم المرتبط بالسورافينيب غير معروفة.
لوحظ وجود شذوذ في المختبر من الدرجة الثالثة أو الرابعة من CTCAE ، بما في ذلك قلة اللمفاويات وقلة العدلات ، في ≥ 5 ٪ من المرضى الذين عولجوا باستخدام سورافينيب.
لوحظ نقص كالسيوم الدم في 12٪ و 26.5٪ من المرضى المعالجين بالسورافينيب مقارنة بـ 7.5٪ و 14.8٪ من المرضى في مجموعة الدواء الوهمي في الدراسة 1 والدراسة 3 على التوالي.كانت حالات نقص كالسيوم الدم خفيفة (CTCAE الصف 1 و 2). حدث نقص كالسيوم الدم من الدرجة الثالثة من CTCAE (6.0 - 7.0 مجم / ديسيلتر) في 1.1٪ و 1.8٪ من المرضى الذين عولجوا باستخدام سورافينيب وفي 0.2٪ و 1.1٪ من المرضى في مجموعة الدواء الوهمي ، ونقص كالسيوم الدم من الدرجة الرابعة CTCAE (
في الدراستين 1 و 3 ، لوحظ انخفاض في البوتاسيوم في 5.4٪ و 9.5٪ من المرضى الذين عولجوا باستخدام سورافينيب على التوالي ، مقارنة بـ 0.7٪ و 5.9٪ من المرضى الذين عولجوا بدواء وهمي. كانت معظم حالات نقص بوتاسيوم الدم خفيفة (CTCAE الصف 1). في هذه الدراسات ، حدث نقص بوتاسيوم الدم من الدرجة الثالثة CTCAE في 1.1٪ و 0.4٪ من المرضى المعالجين بالسورافينيب و 0.2٪ و 0.7٪ من المرضى في المجموعة الثانية ، حالات نقص بوتاسيوم الدم من الدرجة الرابعة CTCAE.
التغييرات في الفحوصات المخبرية لدى مرضى DTC (دراسة 5)
لوحظ نقص كالسيوم الدم في 35.7٪ من المرضى المعالجين بالسورافينيب مقارنة مع 11.0٪ من المرضى في مجموعة الدواء الوهمي. كانت معظم حالات نقص كالسيوم الدم خفيفة في الشدة. حدث نقص كالسيوم الدم من الدرجة الثالثة في CTCAE في 6.8٪ من المرضى الذين عولجوا ب سورافينيب و 1.9٪ من المرضى في المجموعة الثانية ، بينما حدث نقص كلس الدم من الدرجة الرابعة CTCAE في 3.4٪ من المرضى.المرضى الذين عولجوا باستخدام سورافينيب و 1.0٪ من المرضى في مجموعة الدواء الوهمي.
تظهر التغييرات المختبرية الأخرى ذات الصلة سريريًا التي لوحظت في الدراسة 5 في الجدول 2.
الجدول 2: شذوذ المختبر الناشئ عن العلاج المبلغ عنه في مرضى DTC (الدراسة 5) في مرحلة التعمية المزدوجة
* معايير المصطلحات العامة للأحداث السلبية (CTCAE) ، الإصدار 3.0
** إن أسباب نقص فوسفات الدم المصاحب لسورافينيب غير معروفة.
الإبلاغ عن ردود الفعل السلبية المشتبه بها
يعد الإبلاغ عن ردود الفعل السلبية المشتبه بها التي تحدث بعد الحصول على ترخيص من المنتج الطبي أمرًا مهمًا ، لأنه يسمح بالمراقبة المستمرة لنسبة الفائدة / المخاطر للمنتج الطبي. يُطلب من المتخصصين في الرعاية الصحية الإبلاغ عن أي ردود فعل سلبية مشتبه بها عبر موقع وكالة الأدوية الإيطالية : www.agenziafarmaco.gov.it/it/responsabili.
04.9 جرعة زائدة
لا توجد علاجات محددة في حالة تناول جرعة زائدة من سورافينيب. أعلى جرعة تمت دراستها سريريًا من سورافينيب هي 800 مجم مرتين يوميًا. الأحداث الضائرة التي لوحظت بعد هذه الجرعة كانت بشكل رئيسي الإسهال والتفاعلات الجلدية. في حالة الاشتباه في جرعة زائدة ، يجب التوقف عن تناول سورافينيب والبدء في العلاج الداعم إذا لزم الأمر.
05.0 الخصائص الصيدلانية
05.1 الخصائص الديناميكية الدوائية
الفصيلة العلاجية: مضادات الأورام ، مثبطات بروتين كينيز.
كود ATC: L01XE05.
سورافينيب هو مثبط للكيناز أظهر خصائص مضادة للتكاثر ومضادة لتولد الأوعية. في المختبر و في الجسم الحي.
آلية العمل والتأثيرات الدوائية
سورافينيب هو مثبط للكيناز يمنع تكاثر الخلايا السرطانية في المختبر. يثبط سورافينيب نمو طيف واسع من الأورام البشرية المزروعة في الفئران الأثيمية ، مما يؤدي أيضًا إلى انخفاض في تكوين الأوعية الورمية.يثبط سورافينيب نشاط الأهداف الموجودة في الخلية السرطانية (CRAF ، BRAF ، V600E BRAF ، c-KIT و FLT- 3) وفي الأوعية الدموية للورم (CRAF و VEGFR-2 و VEGFR-3 و PDGFR-). كينازات RAF هي كينازات سيرين / ثريونين ، في حين أن c-KIT و FLT-3 و VEGFR-2 و VEGFR-3 و PDGFR-هي مستقبلات كينازات التيروزين.
الفعالية السريرية
تمت دراسة السلامة والفعالية السريرية لعقار سورافينيب في المرضى الذين يعانون من سرطان الخلايا الكبدية (سرطانة الخلايا الكبدية، HCC) ، في المرضى الذين يعانون من سرطان الخلايا الكلوية المتقدم (سرطان الخلايا الكلوية، RCC) وفي المرضى الذين يعانون من سرطان الغدة الدرقية المتمايز (سرطان الغدة الدرقية المتمايز، DTC).
سرطان الكبد
كانت الدراسة 3 (الدراسة 100554) عبارة عن دراسة سريرية متعددة المراكز ، عشوائية ، مزدوجة التعمية ، خاضعة للتحكم الوهمي ، المرحلة الثالثة من الدراسة السريرية الدولية في 602 مريضًا بسرطان الخلايا الكبدية. كانت الخصائص الديموغرافية الأساسية وخصائص المرض قابلة للمقارنة بين مجموعة سورافينيب ومجموعة الدواء الوهمي فيما يتعلق بتصنيف Estern Cooperative Oncology Group (ECOG) (الدرجة 0: 54٪ مقابل 54٪ ؛ الصف 1: 38٪ مقابل 39٪ ؛ الصف 2: 8٪ مقابل 7٪) ، لتصنيف TNM (المرحلة الأولى:
تم إغلاق الدراسة بعد أن تجاوز تحليل البقاء الكلي المؤقت المخطط له حد الفعالية المحدد مسبقًا. أظهر تحليل نظام التشغيل هذا زيادة ذات دلالة إحصائية في نظام التشغيل للمرضى المعالجين بالسورافينيب مقارنة بالمرضى المعالجين بالغفل (HR: 0.69 ، p = 0.00058 ، انظر الجدول 3).
في هذه الدراسة ، كانت بيانات المرضى الذين يعانون من اختلال كبدي لدى Child Pugh B محدودة ، وتم تضمين مريض واحد فقط من الطفل Pugh C.
الجدول 3: نتائج الفعالية من الدراسة 3 (دراسة 100554) في سرطان الكبد
CI = فاصل الثقة ، معدل ضربات القلب = نسبة المخاطر (سورافينيب على الدواء الوهمي)
* ذات دلالة إحصائية حيث أن القيمة p كانت أقل من حد القطع الافتراضي لـ O "Brien Fleming ، المحدد عند 0.0077
** مراجعة إشعاعية مستقلة
قامت المرحلة الثانية ، الدولية ، متعددة المراكز ، العشوائية ، مزدوجة التعمية ، التي خضعت للتحكم بالغفل (الدراسة 4 ، 11849) بتقييم الفائدة السريرية لسورافينيب في 226 مريضًا مصابًا بسرطان الكبد المتقدم. أكدت هذه الدراسة ، التي أجريت في الصين وكوريا وتايوان ، نتائج الدراسة 3 فيما يتعلق بخصائص مخاطر الفوائد الإيجابية لـ sorafenib (HR (OS): 0.68 ، p = 0.01414).
في عوامل التقسيم الطبقي المحددة مسبقًا (تصنيف ECOG ، وجود أو عدم وجود غزو وعائي مجهري و / أو انتشار الورم خارج الكبد) للدراسات 3 و 4 ، كانت الموارد البشرية تؤيد باستمرار سورافينيب على الدواء الوهمي. اقترحت تحليلات المجموعات الفرعية الاستكشافية تأثيرًا علاجيًا أقل وضوحًا في المرضى الذين يعانون من نقائل بعيدة بالفعل عند خط الأساس.
سرطان الخلايا الكلوية
تمت دراسة مدى تحمل وفعالية سورافينيب في علاج سرطان الخلايا الكلوية المتقدم (RCC) في دراستين سريريتين:
كانت الدراسة 1 (الدراسة 11213) عبارة عن دراسة إكلينيكية متعددة المراكز ، عشوائية ، مزدوجة التعمية ، خاضعة للتحكم الوهمي ، أجريت على 903 مرضى. تم تسجيل المرضى الذين يعانون من أورام كلوية صافية وذات عامل خطر منخفض ومتوسط وفقًا لـ MSKCC. ال نقطة النهايةكان الأساسي هو البقاء على قيد الحياة بشكل عام (نظام التشغيل ، شاملة نجاة) والبقاء على قيد الحياة بدون تقدم (PFS ، التقدم حر نجاة).
كان ما يقرب من نصف المرضى يعانون من حالتهم العامة تساوي 0 على مقياس ECOG ، وكان نصف المرضى ينتمون إلى المجموعة النذير بدرجة منخفضة وفقًا لتصنيف MSKCC.
تم تقييم PFS وفقًا لمعايير RECIST مع مراجعة إشعاعية مستقلة أعمى. تم إجراء تحليل PFS على 342 حدثًا في 769 مريضًا.كان متوسط قيمة PFS 167 يومًا في المرضى المعالجين بالسورافينيب مقارنة بـ 84 يومًا في المرضى الذين تلقوا العلاج الوهمي (HR = 0.44 ؛ 95٪ CI: 0.35 - 0.55 ؛ p
تحليل مؤقت (التحليل الثاني مؤقت) من أجل البقاء بشكل عام (شاملة نجاة) على 367 حالة وفاة في 903 مرضى. كانت قيمة ألفا الاسمية لهذا التحليل 0.0094. كان متوسط البقاء على قيد الحياة 19.3 شهرًا في المرضى المعالجين بالسورافينيب ، مقارنة بـ 15.9 شهرًا في المرضى الذين تم اختيارهم عشوائياً للعلاج الوهمي (HR = 0.77 ؛ 95٪ CI: 0.63-0.95 ؛ P = 0.015). في وقت التحليل ، تحول ما يقرب من 200 مريض من مجموعة الدواء الوهمي إلى مجموعة سورافينيب.
كانت الدراسة 2 عبارة عن دراسة للمرحلة الثانية مع التوقف العشوائي عن العلاج في المرضى الذين يعانون من سرطان النقيلي ، بما في ذلك RCC. تم اختيار المرضى الذين يعانون من مرض مستقر والذين يخضعون للعلاج بالسورافينيب بشكل عشوائي إلى العلاج الوهمي أو استمرار العلاج بالسورافينيب. كان PFS في المرضى الذين يعانون من RCC أكبر بكثير (163) أيام) للمرضى المعالجين بالسورافينيب أكثر من المرضى الذين عولجوا بدواء وهمي (41 يومًا) (ع = 0.0001 ، معدل ضربات القلب = 0.29).
سرطان الغدة الدرقية المتمايز (DTC)
كانت الدراسة 5 (دراسة 14295) عبارة عن دراسة دولية متعددة المراكز وعشوائية ومزدوجة التعمية ومضبوطة بالغفل أجريت على 417 مريضًا مع DTC المتقدم محليًا أو النقيلي. كان البقاء على قيد الحياة بلا تقدم (PFS) ، كما هو محدد من خلال التقييم الإشعاعي المستقل الأعمى استنادًا إلى معايير RECIST ، هو نقطة النهاية الأولية للدراسة. تضمنت نقاط النهاية الثانوية البقاء الكلي (OS) ، ومعدل استجابة الورم ، ومدة الاستجابة بعد التقدم ، يمكن للمرضى تلقي سورافينيب مفتوح التسمية.
تم تضمين المرضى في الدراسة إذا تقدموا في غضون 14 شهرًا قبل التسجيل وإذا كان لديهم DTC حراري لليود المشع (اليود المشع، RAI).تم تعريف DTC المقاومة لليود على أنه وجود آفة غير معززة باليود على التصوير الومضاني المشع ، أو الإعطاء التراكمي لـ RAI 22.2 GBq ، أو التقدم بعد علاج اليود المشع خلال الـ 16 شهرًا الماضية. التسجيل أو بعد علاجين باستخدام اليود في مسافة أقصاها 16 شهرا من بعضها البعض.
كانت التركيبة السكانية الأساسية وخصائص المريض متوازنة بشكل جيد في مجموعتي العلاج. كانت النقائل موجودة في الرئتين في 86٪ وفي الغدد الليمفاوية في 51٪ وفي العظام في 27٪ من المرضى. كان متوسط نشاط اليود المشع التراكمي الذي تم إدارته قبل التسجيل حوالي 14.8 جيجابايت. كان لدى معظم المرضى سرطان حليمي (56.8٪) ، يليه سرطان جرابي (25.4٪) وسرطان ضعيف التمايز (9.6٪).
كان متوسط الوقت اللازم لـ PFS 10.8 شهرًا في مجموعة sorafenib ، مقارنة بـ 5.8 شهرًا في مجموعة الدواء الوهمي. (معدل ضربات القلب = 0.587 ؛ فاصل الثقة 95٪ (CI): 0.454 ، 0.758 ؛ ف أحادي الجانب
كان تأثير سورافينيب على PFS ثابتًا بغض النظر عن المنطقة الجغرافية والعمر فوق أو أقل من 60 عامًا والجنس والأنسجة ووجود أو عدم وجود النقائل العظمية.
في تحليل البقاء الشامل الذي تم إجراؤه بعد 9 أشهر من الموعد النهائي لتحليل PFS النهائي ، لم يكن هناك فرق معتد به إحصائيًا في البقاء على قيد الحياة الإجمالي بين مجموعات العلاج (HR 0.884 ؛ CI 95٪: 0.633 ؛ 1.236 ، أحادي الجانب p- بقيمة 0.236). لم يتم تحقيق نظام التشغيل الوسيط في ذراع سورافينيب ، بينما كان 36.5 شهرًا في ذراع الدواء الوهمي.تم اختيار مائة وسبعة وخمسين مريضًا (75٪) عشوائيًا للعلاج الوهمي و 61 مريضًا (30٪) تم اختيارهم بشكل عشوائي إلى سورافينيب.
كان متوسط مدة العلاج في مرحلة التعمية المزدوجة 46 أسبوعًا (المدى 0.3-135) للمرضى الذين تلقوا سورافينيب و 28 أسبوعًا (المدى 1.7-132) للمرضى الذين تلقوا العلاج الوهمي.
لم يلاحظ أي رد كامل (استجابة كاملة، CR) وفقًا لمعايير RECIST. معدل الاستجابة العام (استجابة جزئية + CR + ، استجابة جزئية (PR)) ، الذي تم تحديده من خلال التقييم الإشعاعي المستقل ، كان أعلى في مجموعة سورافينيب (24 مريضًا ، 12.2٪) مقارنة بمجموعة الدواء الوهمي (مريض واحد ، 0.5٪) ، ف أحادي الجانب
أظهر التحليل اللاحق للمجموعات الفرعية استنادًا إلى الحجم الأقصى للورم تأثيرًا علاجيًا على PFS لصالح سورافينيب مقارنةً بالدواء الوهمي في المرضى الذين يعانون من أقصى حجم لآفة الورم يبلغ 1.5 سم أو أكثر (HR 0.54 (95٪ CI: 0.41-0.71)) ، بينما تم تسجيل تأثير عددي أقل في المرضى الذين يعانون من أقصى حجم لآفة الورم أقل من 1.5 سم (HR 0.87 (95٪ CI: 0.40 -1.89)).
أظهر تحليل ما بعد المخصص بناءً على الأعراض المرتبطة بسرطان الغدة الدرقية الموجودة في ظروف خط الأساس تأثيرًا علاجيًا على PFS لصالح سورافينيب على الدواء الوهمي في كل من المرضى الذين يعانون من أعراض وغير أعراض. 0.72) للمرضى الذين يعانون من الأعراض عند خط الأساس و 0.60 (95٪ CI: 0.45 - 0.81) للمرضى بدون أعراض في الحالات القاعدية.
إطالة فترة QT
في دراسة علم الصيدلة السريرية ، تم قياس QT / QTc في 31 مريضًا في الأساس (قبل العلاج) وبعد العلاج. بعد دورة علاج مدتها 28 يومًا ، في وقت أقصى تركيز سورافينيب ، تم إطالة فترة QTcB بمقدار 4 ± 19 مللي ثانية و QTcF بمقدار 9 ± 18 مللي ثانية ، مقارنة بخط الأساس لمجموعة الدواء الوهمي. لم يظهر أي مريض قيمة QTcB أو QTcF> 500 ميللي ثانية أثناء مراقبة تخطيط القلب بعد العلاج (انظر القسم 4.4).
سكان الأطفال
تنازلت وكالة الأدوية الأوروبية عن التزامها بتقديم نتائج الدراسات في جميع المجموعات الفرعية للأطفال من أجل سرطان الكلى والحوض الكلوي (باستثناء الورم الأرومي الكلوي ، والورم الأرومي الكلوي ، وساركوما الخلايا الصافية ، والورم الكلوي المتوسط ، وسرطان النخاع الكلوي ، والورم الرهابي في الكلى) وسرطان الكبد والقناة الصفراوية داخل الكبد (باستثناء الورم الأرومي الكبدي) وسرطان الغدة الدرقية المتمايز (انظر القسم 4.2 للحصول على معلومات حول استخدام الأطفال).
05.2 "خصائص حركية الدواء
الامتصاص والتوزيع
بعد تناول أقراص سورافينيب ، يكون متوسط التوافر البيولوجي النسبي 38-49٪ بالمقارنة مع المحلول الفموي. التوافر البيولوجي المطلق غير معروف. بعد تناوله عن طريق الفم ، يصل سورافينيب إلى أعلى مستوياته في البلازما في حوالي 3 ساعات. عند تناول وجبة غنية بالدهون ، يقل امتصاص سورافينيب بحوالي 30٪ مقارنة بالإعطاء في حالة الصيام.
يزيد متوسط Cmax و AUC أقل من متناسب مع الجرعات التي تزيد عن 400 مجم مرتين يوميًا. بروتين البلازما رابط سورافينيب في المختبر هو 99.5٪.
أدت الجرعات المتكررة من سورافينيب لمدة 7 أيام إلى تراكم 2.5 إلى 7 أضعاف مقارنة بالإعطاء الفردي. تتحقق الحالة الثابتة من سورافينيب في غضون 7 أيام ، مع معدل تركيز في البلازما من الذروة إلى الحوض الصغير أقل من 2.
تم تحديد تركيزات التوازن من سورافينيب عند 400 مجم مرتين يوميًا في المرضى الذين يعانون من DTC و RCC و HCC. لوحظ أعلى متوسط تركيز في المرضى الذين يعانون من DTC (تقريبًا ضعف ما لوحظ في المرضى الذين يعانون من RCC و HCC) ، ولكن التباين كان مرتفعًا لجميع أنواع الأورام سبب هذا التركيز العالي في مرضى DTC غير معروف.
التحول البيولوجي والقضاء
يبلغ عمر النصف للتخلص من سورافينيب ما يقرب من 25 إلى 48 ساعة. يتم استقلاب سورافينيب بشكل أساسي في الكبد عن طريق التمثيل الغذائي المؤكسد بوساطة CYP3A4 و اقتران الجلوكورونو بوساطة UGT1A9. يمكن إطلاق سورافينيب المقترن في الجهاز الهضمي عن طريق نشاط الجلوكورونيداز لبعض البكتيريا ، مما يسمح بإعادة امتصاص المكون النشط غير المقترن ، وقد لوحظ أن الجمع بين النيومايسين يتداخل مع هذه العملية ، مما يقلل من متوسط التوافر الحيوي للسورافينيب بنسبة 54٪.
يمثل سورافينيب حوالي 70 - 85٪ من المواد التحليلية المتداولة في بلازما الحالة المستقرة. تم تحديد ثمانية مستقلبات من سورافينيب ، تم العثور على خمسة منها في البلازما. المستقلب الرئيسي للسورافينيب المنتشر في البلازما ، بيريدين أكسيد النيتروجين ، يظهر فاعليةفي المختبر على غرار سورافينيب. يمثل هذا المستقلب ما يقرب من 9 - 16٪ من المواد التحليلية المتداولة في حالة مستقرة.
بعد تناول جرعة 100 مجم من محلول سورافينيب عن طريق الفم ، تمت استعادة 96٪ من الجرعة خلال 14 يومًا: 77٪ في البراز و 19٪ في البول كمستقلبات للجلوكورونات. تم استرداد سورافينيب غير المتغير ، والذي يمثل 51٪ من الجرعة ، في البراز وليس في البول ، مما يشير إلى أن إفراز القنوات الصفراوية للمادة الفعالة غير المستقلب قد يساهم في التخلص من سورافينيب.
حركية الدواء في فئات معينة من المرضى
أظهر تحليل البيانات الديموغرافية أنه لا توجد علاقة بين الحرائك الدوائية والعمر (حتى 65 سنة) والجنس أو وزن الجسم.
سكان الأطفال
لم يتم إجراء أي دراسات للتحقق من الحرائك الدوائية لسورافينيب في مرضى الأطفال.
العنصر
لا توجد فروق ذات صلة سريريًا في الحرائك الدوائية بين الموضوعات القوقازية والآسيوية.
القصور الكلوي
في أربع دراسات سريرية من المرحلة الأولى ، كان التعرض المستقر للسورافينيب في المرضى الذين يعانون من ضعف كلوي خفيف أو متوسط مماثل لتلك الموجودة في المرضى الذين يعانون من وظائف الكلى الطبيعية. بين التعرض لسورافينيب ووظيفة الكلى في الأشخاص الذين يعانون من وظائف الكلى الطبيعية أو ضعف كلوي خفيف أو متوسط أو شديد. لا توجد بيانات متاحة عن المرضى الذين يحتاجون إلى غسيل الكلى.
اختلال كبدي
في مرضى سرطان الكبد (HCC) ومع تقييم اختلال كبدي على أنه Child-Pugh A أو B (خفيف إلى متوسط) ، كانت قيم التعرض قابلة للمقارنة وضمن النطاق الملحوظ في المرضى الذين لا يعانون من اختلال كبدي. كانت الحرائك الدوائية للسورافينيب في مرضى Child-Pugh A و B دون سرطان الكبد مماثلة لتلك التي شوهدت لدى المتطوعين الأصحاء. لا توجد بيانات عن المرضى الذين يعانون من اختلال كبدي شديد (Child-Pugh C). يتم التخلص من عقار سورافينيب في المقام الأول عن طريق الكبد ويمكن زيادة التعرض في هذه الفئة من السكان المرضى.
05.3 بيانات السلامة قبل السريرية
تم تقييم ملف السلامة قبل السريرية لسورافينيب في الفئران والجرذان والكلاب والأرانب.
كشفت دراسات السمية المتكررة للجرعات عن تغيرات في أعضاء مختلفة (انحطاط وتجديد) عند التعرض أقل من الجرعات المستخدمة في الدراسات السريرية (بناءً على مقارنة الجامعة الأمريكية بالقاهرة).
بعد الجرعات المتكررة في الكلاب الصغيرة والنامية ، لوحظت تأثيرات على العظام والأسنان عند التعرض للجرعات أقل من الجرعات المستخدمة في الدراسات السريرية. وتألفت هذه التأثيرات من سماكة غير متساوية لصفيحة نمو عظم الفخذ ونقص تنسج النخاع بالقرب من ألواح النمو المتغيرة والتغيرات في تكوين العاج. لم تحدث تأثيرات مماثلة في الكلب البالغ.
تم إجراء البرنامج القياسي لدراسات السمية الجينية وتم الحصول على نتائج إيجابية حيث لوحظت زيادة في الانحرافات الهيكلية الصبغية في اختبار واحد. في المختبر في خلايا الثدييات (مبيض الهامستر الصيني) لقياس التكاثر في وجود التنشيط الأيضي. لم يكن سورافينيب سامًا للجينات في اختبار أميس أو اختبار النواة الدقيقة في الجسم الحي في الفأرة. وسيط في عملية التصنيع ، وهو موجود أيضًا في المادة الفعالة النهائية (في المختبر على الخلايا البكتيرية (اختبار أميس). بالإضافة إلى ذلك ، تضمنت مجموعة سورافينيب المختبرة في البطارية المعيارية السامة للجينات 0.34٪ PAPE.
لم يتم إجراء دراسات السرطنة باستخدام سورافينيب.
لم يتم إجراء دراسات حيوانية محددة باستخدام سورافينيب لتقييم التأثير على الخصوبة. من المتوقع حدوث تأثير سلبي على خصوبة الذكور والإناث ، حيث أظهرت دراسات الجرعات المتكررة على الحيوانات تغيرات في الأعضاء التناسلية للذكور والإناث عند التعرض أقل من الجرعات المستخدمة في التجارب السريرية (بناءً على الجامعة الأمريكية بالقاهرة). علامات تنكس وتأخر نمو الخصيتين ، البربخ ، البروستاتا والحويصلات المنوية في الفئران.أظهرت إناث الجرذان نخر مركزي في الجسم الأصفر وانسداد نمو الجريب في المبايض ، وأظهرت الكلاب تنكس أنبوبي في المبايض ، الخصيتين وقلة النطاف.
لقد ثبت أن سورافينيب سام للأجنة وماسخ عند إعطائه للجرذان والأرانب عند تعرض أقل من الجرعات المستخدمة في الدراسات السريرية. وشملت الآثار التي لوحظت انخفاض في وزن جسم الأم والجنين ، وزيادة في عدد ارتشاف الجنين ، وزيادة عدد التشوهات الخارجية والحشوية.
أظهرت دراسات تقييم المخاطر البيئية أن سورافينيب توزيلات يحتمل أن يكون ثابتًا ومتراكمًا بيولوجيًا وسامًا للبيئة. تتوفر معلومات حول تقييم المخاطر البيئية في تقرير التقييم العام الأوروبي (EPAR) لهذا المنتج الطبي (انظر القسم 6.6).
06.0 المعلومات الصيدلانية
06.1 السواغات
جوهر الجهاز اللوحي:
الصوديوم Croscarmellose
السليلوز الجريزوفولفين
هيبروميلوز
كبريتات لوريل الصوديوم
ستيرات المغنيسيوم
طلاء القرص:
هيبروميلوز
ماكروغول
ثاني أكسيد التيتانيوم (171 هـ)
أكسيد الحديد الأحمر (E 172)
06.2 عدم التوافق
غير ذات صلة.
06.3 فترة الصلاحية
3 سنوات.
06.4 احتياطات خاصة للتخزين
لا تخزن فوق 25 درجة مئوية.
06.5 طبيعة العبوة الفورية ومحتويات العبوة
كرتونة تحتوي على 112 مضغوطة ملبسة بالفيلم (4 × 28) مغلفة بغلاف شفاف (PP / ألمنيوم).
06.6 تعليمات الاستخدام والتداول
قد يشكل هذا المنتج الطبي خطرًا محتملاً على البيئة ، ويجب التخلص من المنتجات الطبية غير المستخدمة والمخلفات المشتقة من هذا المنتج الطبي وفقًا للوائح المحلية.
07.0 حامل ترخيص التسويق
باير فارما ايه جي
13342 برلين
ألمانيا
08.0 رقم ترخيص التسويق
EU / 1/06/342/001
037154010
09.0 تاريخ أول تفويض أو تجديد التفويض
تاريخ أول ترخيص: 19 يوليو 2006
تاريخ آخر تجديد: 21 يوليو 2011
10.0 تاريخ مراجعة النص
05/2014







-cos-cause-sintomi-e-cura.jpg)




.jpg)